- 410.50 KB
- 9页
- 1、本文档共5页,可阅读全部内容。
- 2、本文档内容版权归属内容提供方,所产生的收益全部归内容提供方所有。如果您对本文有版权争议,可选择认领,认领后既往收益都归您。
- 3、本文档由用户上传,本站不保证质量和数量令人满意,可能有诸多瑕疵,付费之前,请仔细先通过免费阅读内容等途径辨别内容交易风险。如存在严重挂羊头卖狗肉之情形,可联系本站下载客服投诉处理。
- 文档侵权举报电话:19940600175。
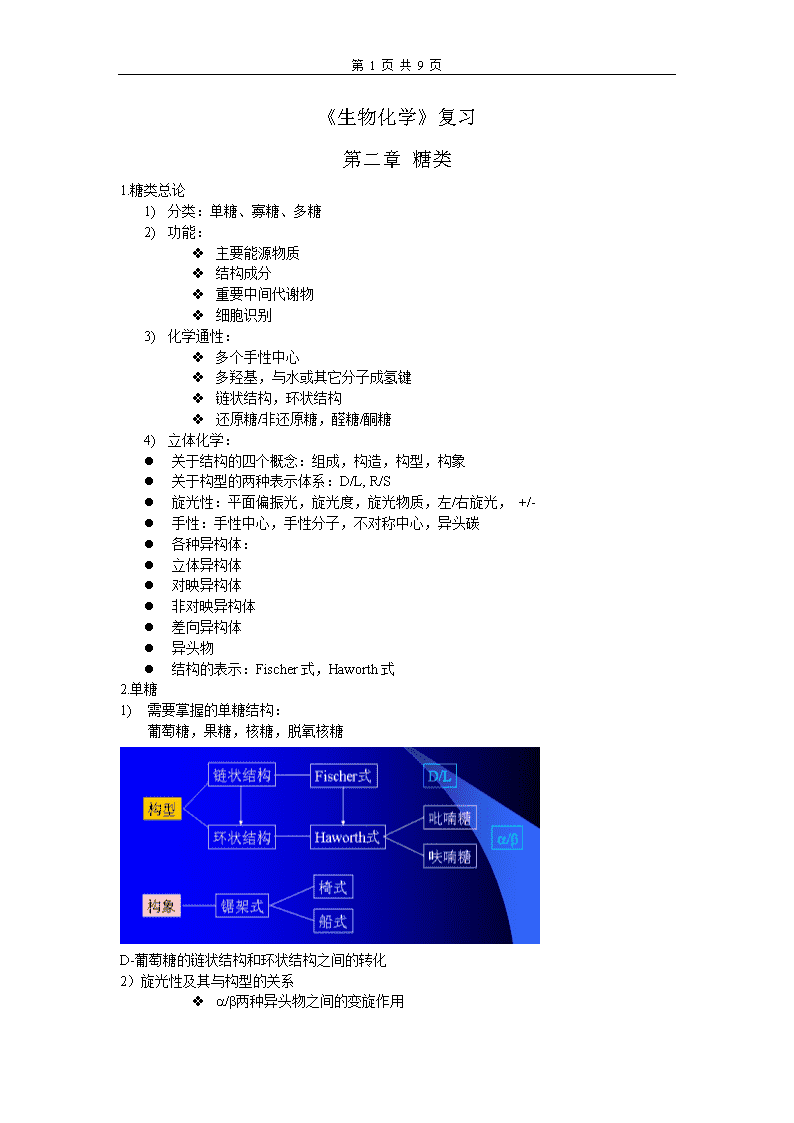
第9页共9页《生物化学》复习第二章糖类1.糖类总论1)分类:单糖、寡糖、多糖2)功能:v主要能源物质v结构成分v重要中间代谢物v细胞识别3)化学通性:v多个手性中心v多羟基,与水或其它分子成氢键v链状结构,环状结构v还原糖/非还原糖,醛糖/酮糖4)立体化学:l关于结构的四个概念:组成,构造,构型,构象l关于构型的两种表示体系:D/L,R/Sl旋光性:平面偏振光,旋光度,旋光物质,左/右旋光,+/-l手性:手性中心,手性分子,不对称中心,异头碳l各种异构体:l立体异构体l对映异构体l非对映异构体l差向异构体l异头物l结构的表示:Fischer式,Haworth式2.单糖1)需要掌握的单糖结构:葡萄糖,果糖,核糖,脱氧核糖D-葡萄糖的链状结构和环状结构之间的转化2)旋光性及其与构型的关系va/b两种异头物之间的变旋作用
第9页共9页vD/L,R/S,+/-之间有关系吗?3)还原糖与非还原糖v(半)缩醛(酮)的概念v什么反应可以用于鉴别还原糖?v酮糖都是非还原糖吗?4)物理性质5)化学性质:鉴别醛糖和酮糖的特征反应v醛糖与酮糖之间的异构化v氧化反应v还原反应v酯化反应和甲基化反应v形成糖脎v形成糖苷:什么是糖苷?如何形成?3.寡糖1)糖苷键及其对酸碱的稳定性2)还原端与非还原端3)区分还原糖与非还原糖4)寡糖的命名与结构,如:v麦芽糖Glc(a1®4b)Glcv蔗糖Glc(a1«2b)Fru4.多糖1)多糖的生物功能2)同多糖与杂多糖及其代表3)淀粉与纤维素在结构与功能上的区别4)细菌细胞壁的主要成分5.复合糖1)复合糖及其主要功能2)蛋白多糖和糖蛋白的区别3)糖脂4)两种糖肽键(O-,N-)6.糖链的结构分析:P.72第三章脂类1.脂质的各种分类,每一类的功能及代表物
第9页共9页2.贮存脂质1)脂肪酸:长链羧酸v分类v结构:不饱和脂肪酸的C=C双键多为顺式(cis)v命名:18:2D9c,12cv性质:熔点/溶解度与结构的关系v必需脂肪酸2)三酰甘油v化学通式v分类:简单三酰甘油,混合三酰甘油v物理性质:熔点与结构的关系v化学性质Ø水解与皂化–皂化值Ø氢化和卤化–碘值Ø乙酰化–乙酰值Ø酸败与自动氧化–酸值3)蜡:长链脂肪酸和长链一元醇形成的酯3.结构脂质1)甘油磷脂–甘油为骨架v化学通式v一般性质Ø物理性质Ø两亲性Ø电荷Ø水解2)鞘磷脂和鞘糖脂–鞘氨醇为骨架3)糖脂和脂蛋白v糖脂–脂和糖通过糖苷键共价结合Ø甘油糖脂Ø鞘糖脂v脂蛋白–脂和蛋白质非共价结合Ø血浆脂蛋白的分类,结构与功能4.活性脂质v萜–异戊二烯v类固醇–甾核5.脂质的分离和分析:P.119第四章氨基酸,肽,蛋白质1.氨基酸1)a-氨基酸的化学通式和一般结构蛋白质中发现的氨基酸都是L型的2)20种常见的蛋白质氨基酸3)光谱性质:A280(Trp,Tyr,Phe)4)氨基酸的酸碱性质
第9页共9页Ø兼性离子Ø可电离基团Ø滴定曲线Ø缓冲范围ØpKaØpIØ电荷5)化学性质Øa-氨基参加的反应Øa-羧基参加的反应Øa-氨基和a-羧基都参加的反应Ø侧链R基参加的反应v哪些反应可用于鉴定氨基酸?v哪些反应可用于氨基酸序列测定?v用离子交换层析分析氨基酸混合物的原理2.肽1)肽键的结构:Ø肽平面Ø共振相互作用Ø反式结构2)肽的结构Ø肽链具有极性Ø氨基酸残基以肽键相连Ø肽链左端为NH2末端,右端为COOH末端3)肽的电离行为Ø滴定曲线ØpI(等电点)ØpKaØ电荷4)肽的化学性质Ø与氨基酸一样有光活性,能进行a-氨基、a-羧基、侧链R基参加的反应Ø鉴定反应:ü双缩脲反应:只适用于肽和蛋白质,不适用于氨基酸ü茚三酮反应:适用于氨基酸、肽和蛋白质3.蛋白质1)蛋白质的化学组成2)蛋白质的各种分类3)蛋白质功能的多样性4)蛋白质的性质Ø酸碱性质:pKa,pI,chargeØ胶体性质5)蛋白质的分离提纯与鉴定Ø根据什么性质采取什么实验手段Ø测定蛋白质分子量有什么方法?
第9页共9页Ø测定蛋白质浓度有什么方法?Ø蛋白质分离提纯的一般步骤是什么?蛋白质的分离提纯第五章蛋白质的结构1.简介1)结构与功能的关系2)稳定蛋白质三维结构的作用力3)蛋白质的四级结构2.一级结构1)什么是蛋白质的一级结构?2)蛋白质的同源性及进化树3)氨基酸序列测定v基本步骤?v确定N端的反应?各有什么特点?a.DNFB–Sanger’smethodb.DNSc.PITC–Edman’smethodv断裂二硫键的反应?v确定C端的方法?a.羧肽酶法3.二级结构1)肽平面,二面角,拉氏构象图2)a螺旋Ø每转0.54nm,3.6个氨基酸残基Ø手性:右手螺旋Ø极性Ø维系a螺旋结构的主要作用力:氢键Ø影响a螺旋结构的主要因素3)b折叠片Ø两种b折叠片:平行和反平行Øb折叠片与a螺旋的氢键有何区别?Ø哪种折叠片结构更稳定?4)b转角5)超二级结构:aa,bab,bb6)结构域7)纤维状蛋白质举例:角蛋白、丝心蛋白、胶原蛋白4.三级结构1)纤维状蛋白和球状蛋白的区别2)球状蛋白三维结构的特点3)球状蛋白三级结构的代表:肌红蛋白5.四级结构1)与四级结构有关的几个概念:P.2422)四级结构的代表:血红蛋白
第9页共9页1)四级结构的对称性2)亚基之间的相互作用3)四级缔合在结构和功能上的优越性6.变性和折叠1)蛋白质的变性和复性2)蛋白质的变性条件v变性剂:尿素、盐酸胍、SDS等v还原剂:b-巯基乙醇v有机溶剂vpHv温度v重金属离子3)核糖核酸酶的变性与复性的经典实验7.氧结合蛋白结构与功能的关系1)蛋白质结构与功能的关系:取决于蛋白质与配体之间的结合a.蛋白质与配体之间的结合:可逆、专一、互补b.蛋白质构象易变:诱导契合c.蛋白质-配体相互作用可被调节:别构效应、协同性2)氧结合蛋白通过辅基血红素与氧进行可逆结合3)肌红蛋白与血红蛋白的比较:结构与功能a.有无别构效应?血红蛋白的协同性氧结合b.氧结合过程中蛋白质结构所发生的变化v血红素的工作原理v远侧组氨酸,近侧组氨酸,及其作用v自由血红素和肌红蛋白内的血红素对O2和CO的亲合度的比较v血红蛋白两种构象态(T态«R态)之间的互换c.两种蛋白质结构的不同对氧结合的影响:v氧结合曲线vHill图d.Bohr效应(H+,CO2)和BPG对血红蛋白载氧的影响及其作用机制:异促效应、负协同性第六章酶1.简介1)酶的性质Ø酶作为蛋白质有什么特殊性质?Ø酶作为催化剂有什么特殊性质?Ø酶与一般化学催化剂比较有什么优越性?2)酶活性的定义Ø酶活力单位Ø比活力Ø转换数3)酶的分类与命名4)酶的分离提纯
第9页共9页Ø酶活力测定的常用方法Ø分离提纯过程用什么参数进行跟踪?2.酶促反应动力学1)米氏方程v中间络合物学说和稳态理论v推导vV-[S]关系v各动力学参数的意义:Km,Vmax,kcat,kcat/Kmv作图法测定Km和Vmax值:双倒数作图法2)酶的抑制作用v几个概念:变性,失活,抑制v可逆抑制和不可逆抑制的区别v三种可逆抑制Ø在与酶作用方面的区别Ø在动力学行为上的区别3)影响酶活性的因素v什么是酶的最适温度和最适pH?3.酶的作用机制1)酶的活性部位2)酶和底物之间的相互作用v酶和底物之间以非共价作用相结合v三种效应:邻近效应,定向效应,互补效应v酶和底物之间的互补性结合Ø分子大小、形状、电荷、疏水/亲水作用Ø两个模型:锁钥理论,诱导契合理论v酶结构应与反应过渡态的结构而不是与底物结构相吻合3)一些活性功能团对酶催化的影响v酸碱催化v共价催化v金属离子催化4)胰凝乳蛋白酶v分子结构v底物专一性v属丝氨酸蛋白酶,都遵循酰基酶催化机制:Ø催化三联体:Ser-His-AspØ涉及到酸碱催化和共价催化Ø反应中间体是什么?Ø过渡态稳定化?第七章核酸1.核酸与核苷酸1)核酸的分类及其生物功能2)核酸的组成Ø碱基:5种主要碱基
第9页共9页Ø核糖:D-b-呋喃糖Ø核苷:b-N-糖苷键,顺式、反式,命名Ø核苷酸:磷酸酯键,命名Ø核酸:3’,5’-磷酸二酯键2)DNA和RNA的主要区别:Ø核糖:C-2’Ø碱基:DNA(T),RNA(U)2.核酸的结构1)核酸(DNA,RNA)的一级结构:主链上的核苷酸序列及其共价结构Ø核苷酸以磷酸二酯键彼此相连Ø主链亲水性Ø磷酸基团彻底电离并带负电Ø直链或环状结构,没有支链Ø核酸的表示方式:5’à3’(左à右,上à下)2)DNA的二级结构vChargaff规则:A=T,G=C,A+G=T+CvDNA分子双螺旋结构模型Ø两条DNA链靠氢键结合,互补,反向平行Ø每旋转一周有10.5个核苷酸,螺距3.6nmØ脱氧核糖,磷酸基团,碱基在双螺旋结构中的位置和取向Ø形成和维持双螺旋结构的两个重要作用力:氢键,碱基堆积vDNA的几种螺旋类型:A,B,Z.v某些DNA序列采取的不寻常结构Ø发夹型和十字型ØHoogsteen配对和Watson-Crick配对Ø三股螺旋:为什么三股螺旋在酸性条件下更稳定?Ø四股螺旋ØH-DNA3)RNA的高级结构vRNA单链的二级结构vRNA能与RNA或DNA配对成双螺旋结构ØGºC,A=U—与DNA相同ØG=U—与DNA不同Ø不寻常的氢键(如磷酸和核糖上的羟基参与成键)v发夹形是RNA最常见的二级结构vtRNA的三叶草二级结构及其三级结构3.核酸的物理化学性质1)水解反应v三种水解反应:酸,碱,酶v如何选择反应条件进行选择性水解?v为什么碱性条件下RNA被水解而DNA不能?2)酸碱性质v核酸上的可电离H+v等电点的计算
第9页共9页1)光谱性质:核酸在260nm附近有强吸收2)变性,复性,杂交v变性,复性(退火),杂交的概念vDNA变性的主要表现:1)氢键破裂使两条单链分离2)粘度下降3)吸光度(A260)上升–增色效应v变性条件v热变性和熔点的概念,以及影响熔点的几个因素v杂交及其应用第八章维生素与辅酶1.维生素v维生素的定义和分类v脂溶性维生素(A,D,E,K)的结构和功能v水溶性维生素的代表(B12,C,H,K)及其功能2.辅酶:维生素来源,结构,工作原理v烟酰胺辅酶(NAD+,NADP+)v黄素辅酶(FAD,FMN)v辅酶A3.作为辅酶的金属离子:在酶催化中的作用与腺嘌呤核苷酸有关的维生素辅酶 V维生素来源与酶的结合转移基团烟酰胺辅酶NAD+/NADHNADP+/NADPHVitaminPP(VitaminB3)松散:H-(e-)黄素辅酶FAD/FADH/FADH2FMN/FMNH/FMNH2VitaminB2紧密:H-(e-)辅酶ACoA/Acyl-CoAVitaminB5(泛酸) 酰基